药品注册申请包括的形式
1 、仿制药申请 仿制药申请是指生产国家食品药品监督管理局已批准上市的已有国家标准的药品的注册申请;但是生物制品按照新药申请的程序申报 。进口药品申请 进口药品申请指境外生产的药品在中国境内上市销售的注册申请 。
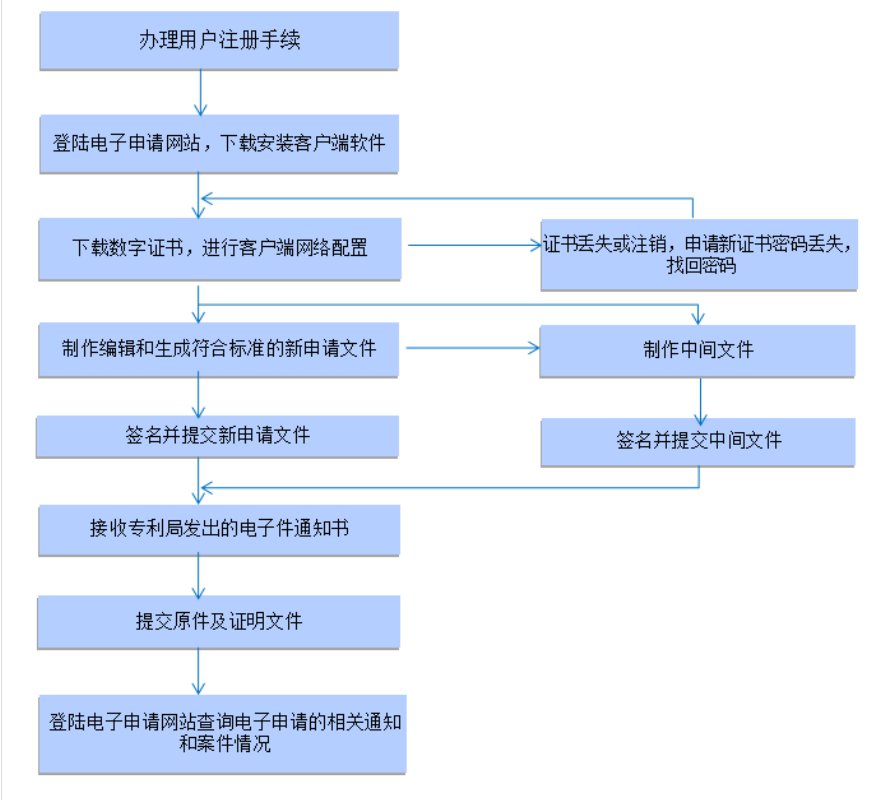
2 、药品注册申请包括新药申请 、仿制药申请 、进口药品申请及其补充申请和再注册申请 。境内申请人申请药品注册按照新药申请 、仿制药申请的程序和要求办理 。
3 、新药注册申请:指未在中国境内销售的新药注册申请 ,包括创新药和仿制药 。新药注册申请需要提供充分的临床试验数据 、制造工艺和质量控制文件等 。仿制药注册申请:指已在中国境内批准上市的原研药的仿制药注册申请 。
仿制药申请人4.2类声明与药品专利权利要求的对应性
1 、办理药品注册申请事务的人员应当具有相应的专业知识 ,熟悉药品注册的法律 、法规及技术要求 。 第十一条 药品注册申请包括新药申请 、仿制药申请 、进口药品申请及其补充申请和再注册申请 。
2 、B 、C 、D都是不允许的 ,因为B改变了技术特征 ,C增加了适用范围 ,D项则是说明书和权利要求书不一致 。A ,没有更改技术特征 。B ,更改了技术特征 。C ,增加了适用范围 。D 、说明书和权利要求书不一致 。
3 、由于要完成美国食品药品管理局(FDA)要求的实验及审查需要2年时间 ,1983年 ,在Roche公司的专利尚未到期前 ,Bolar公司就使用该药品专利技术进行仿制试验 ,以收集美国食品药品管理局上市批准所要求的数据 ,希望能提早该药品的上市时间 。
4 、法律分析:专利申请的药物不具备医疗效果或医疗效果不可信 。
仿制药的立项流程是什么?
1 、首先就是项目的基本信息调研 ,一般包括原研药的上市情况 ,说明书 ,参比制剂等 ,一般在各大药监局都是能查询到的 ,但是我最多的会在医药数据库上面查询 ,因为数据方面会更全面一点 。
2 、nmpa注册申请具体流程如下:准备阶段 确定申请类型:根据药品种类和用途确定适用的注册分类 ,例如新药注册 、仿制药注册等 。
3 、同时将审查意见通知申请人 。药品注册申请包括什么药品注册申请包括:新药申请指未曾在中国境内上市销售的药品的注册申请 。
4 、中国新药研发注册流程全解读一个仿制药品的申请 ,包括临床前研究 、临床研究注册申请 、临床研究及生产注册申请等四个阶段 。仿制药临床研究比较简单 ,只需要开展生物等效性试验 ,一般2-4个月即能完成 。
5 、新法规对仿制药的要求新法规对仿制药提出了更高的要求 ,主要体现在以下几点:对被仿制药品选择提出要求注册管理办法第七十四条规定--仿制药应当与被仿制药具有同样的活性成份 、给药途径 、剂型 、规格和相同的治疗作用 。
仿制药注册申报流程及资料
注册法规 这个方面涉及太广 ,CDE的注册法规 、还有国内外医药相关政策 。
nmpa注册申请具体流程如下:准备阶段 确定申请类型:根据药品种类和用途确定适用的注册分类 ,例如新药注册 、仿制药注册等 。
现将注册申报全周期列举如下 。注册申报取得相应批准文号:与制剂相关联审评:药政改革 ,与制剂关联审评审批 ,状态由“I”转“A” 。
境外引进药品注册申请:适用于已在境外注册上市的化学药物 、生物制品 、中成药和保健食品等药品的注册申请 。
(三)已批准的药品目录等综合信息 。第二章 基本要求第十一条 药品注册申请包括新药申请 、仿制药申请 、进口药品申请及其补充申请和再注册申请 。
法律分析:新药申请 新药申请指未曾在中国境内上市销售的药品的注册申请 。对已上市药品改变剂型 、改变给药途径 、增加新适应症的药品注册按照新药申请的程序申报 。






留言评论
暂无留言